A imunização e a COVID-19
9 jun 2020
Bárbara Patrícia de Morais*
*Especialista de produtos da Labtest
Nesta terça-feira, 9 de junho, celebra-se o Dia da Imunização. A data que relembra a importância da vacinação para a prevenção de doenças é comemorada anualmente. Já contamos um pouco sobre a vacinação e sua relevância no artigo Dia Nacional da Vacinação e o perigo das fake news.
Em meio à pandemia da COVID-19, esse assunto ganha ainda mais importância e a corrida pelo desenvolvimento de vacinas para combater a disseminação do SARS-CoV-2 tomou grandes proporções. A necessidade do desenvolvimento de uma vacina, em tempo recorde, ocupa a comunidade científica de todas as partes do planeta.
Entretanto, como já abordamos no artigo Resposta Imunológica da COVID-19, pouco se sabe sobre o curso dessa resposta, inclusive se existe possibilidade de reinfecção, o que torna o desenvolvimento de uma vacina eficiente ainda mais desafiador. De acordo com a Organização Mundial da Saúde (OMS), até 2 de junho, 10 possíveis vacinas estavam em avaliação na fase clínica e 123 em avaliação na fase pré-clínica.1
De um modo geral, a imunidade adquirida ativa pode ocorrer de duas formas: exposição natural ao agente etiológico causador da doença ou de forma artificial através da vacinação. Abordamos mais sobre a imunidade adquirida e seus tipos no artigo Diagnóstico in vitro: uma introdução à resposta imunológica. Para COVID-19, ainda não se sabe se a exposição ao vírus SARS-CoV-2 é capaz de desenvolver no indivíduo infectado anticorpos específicos neutralizantes, caracterizando uma memória imunológica eficaz e conferindo imunidade permanente.
O processo de desenvolvimento de uma vacina, em um panorama tradicional, é longo e demanda muitos investimentos. Inicialmente, é necessário escolher adequadamente o imunógeno e formulá-lo com determinadas características que permitam a avaliação da possível vacina em um estudo pré-clínico. Em seguida, há a fase clínica, onde ocorre a testagem da possível vacina em humanos, verificando a sua eficácia e segurança. Se aprovada e considerada segura, a vacina, então, poderá ser produzida em larga escala. Até hoje, a que foi produzida mais rapidamente foi a contra o Ebola, que levou cerca de 6 anos entre o seu desenvolvimento e a sua disponibilização2. Em um cenário de pandemia como o que vivemos agora, essas fases se sobrepõem fazendo com que várias dessas atividades sejam conduzidas simultaneamente.
Segundo artigo publicado no periódico The New England Journal of Medicine por Lurie e colaboradores2 (2020), o desenvolvimento da vacina para a COVID-19 tem três grandes desafios: primeiro, a escolha do imunógeno ideal. Apesar da proteína S (spike) ser, em linhas gerais, considerada um imunógeno promissor, a escolha de quais regiões da proteína serão mais adequadas para serem utilizadas no design final da vacina é altamente crítica e determinante para que a resposta imunológica seja otimizada. Segundo, efeitos colaterais decorrentes do estímulo à produção de anticorpos. Estudos pré-clínicos realizados durante os estágios iniciais do desenvolvimento de vacinas para SARS e MERS levantaram preocupações quanto ao agravamento do quadro pulmonar, efeito observado seja diretamente ou dependente da quantidade de anticorpos produzidos. Terceiro, dados sobre imunidade. Embora o fenômeno de proteção possa ser inferido decorrente da experiência obtida nos estudos de desenvolvimento de vacinas para SARS e MERS, para a COVID-19, o estabelecimento da imunidade ainda não é consenso e caso seja real, é necessário caracterizar a duração de sua permanência, bem como a dose de anticorpos necessária para atingi-la.
Cheng e colaboradores3 (2020) também relatam alguns desafios em sua recente revisão, para a revista Annals of Internal Medicine. De acordo com os autores, testes sorológicos são essenciais para compreender a imunidade para o SARS-CoV-2 e guiar o desenvolvimento das vacinas. Para eles, apesar de a proteína S ser um alvo promissor para as vacinas, uma vez que os anticorpos específicos se ligam a três regiões dessa proteína (S1, S2 e RBD), sendo esta última associada aos anticorpos neutralizantes, sabe-se que esta região é a de maior variabilidade no genoma do vírus, o que pode dificultar o desenvolvimento de uma vacina eficaz. A proteína N é mais conservada, entretanto, o seu papel na resposta imunológica ainda não está totalmente elucidado.
Como mencionado anteriormente, as possíveis vacinas para a COVID-19 encontram-se em fase de desenvolvimento e temos cinco principais plataformas de tecnologia empregadas para a sua obtenção, conforme Tabela 1:
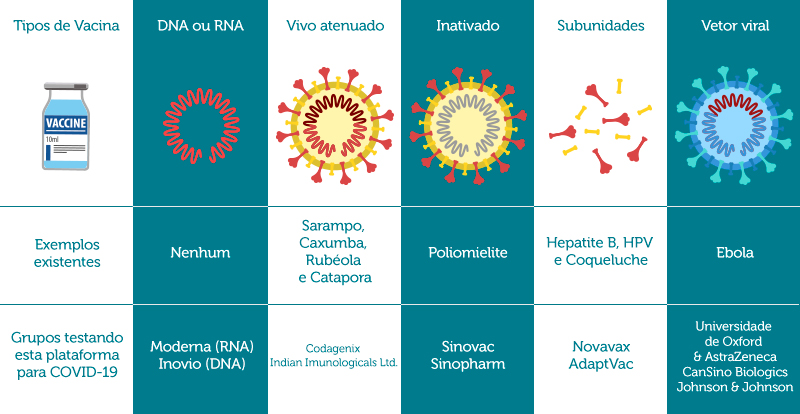
Fonte: CDC, NIAID, WRAIR, FDA
Tabela 1. Principais plataformas de tecnologia empregadas no desenvolvimento de vacinas para COVID-19 (adaptada).
– DNA ou RNA: utiliza DNA ou RNA para ensinar o sistema imunológico a reconhecer as principais proteínas virais. Nenhuma vacina atualmente emprega esta tecnologia.
– Vivo atenuado: utiliza uma versão enfraquecida do vírus. Esta plataforma é utilizada nas vacinas para Sarampo, Caxumba, Rubéola e Catapora.
– Inativado: utiliza o vírus inteiro morto, empregando-se calor ou substâncias capazes de levar o vírus à morte. A vacina para Poliomietite usa esta tecnologia.
– Subunidades: emprega pedaços do vírus para direcionar o sistema imunológico para um único alvo. Esta tecnologia é empregada nas vacinas para Hepatite B, HPV e Coqueluche.
– Vetor viral: incorpora o material genético do vírus de interesse em outro vírus, que entrega os genes virais de forma a construir a imunidade. A vacina para Ebola emprega esta tecnologia.
Um artigo publicado na The Lancet por Zhu e colaboradores4 (2020) demonstra o que foi observado para uma possível vacina que emprega esta última plataforma. A vacina para COVID-19 vetorizada em Adenovírus Tipo 5 recombinante (CanSion) foi aplicada em uma única dose, em 108 indivíduos, divididos em três grupos, de 36 participantes cada. Um grupo recebeu uma dose baixa, outro recebeu uma dose média e o último grupo recebeu uma dose alta. Os indivíduos selecionados para este estudo foram negativos para os testes sorológicos para COVID-19 (IgM e IgG) e para a pesquisa do ácido nucleico viral e não apresentaram lesões nos pulmões, de acordo com os exames de imagem.
As amostras foram coletadas 14 e 28 dias após a aplicação intramuscular da possível vacina. A produção de anticorpos foi avaliada com kits de ELISA disponíveis comercialmente e a neutralização dos anticorpos através de testes com o vírus vivo e com pseudovírus. Células T específicas também foram quantificadas. Anticorpos específicos ao RBD foram observados nos três grupos avaliados, a partir de 14 dias. Anticorpos neutralizantes foram negativos no dia 0, aumentaram moderadamente no dia 14 e tiveram o seu pico no dia 28. O pico da quantidade de células T foi observado 14 dias após a vacinação. Os resultados encontrados indicam que a possível vacina foi imunogênica, induzindo uma resposta celular e humoral na maioria dos participantes.
Os autores ainda afirmam que duas doses (baixa e média) foram escolhidas para avançar para a fase clínica 2 e reforçam que evidências de proteção de uma vacina para COVID-19 ainda são desconhecidas, pois o papel dos anticorpos específicos e das células T na construção da proteção efetiva ainda não está completamente definido.
Diante disso, sabemos que muitos esforços ainda serão necessários, até que se encontre uma vacina eficiente e segura para a COVID-19. Contudo, a importância da vacinação na prevenção e erradicação de diversas doenças é imensurável. É importante manter o cartão de vacinas atualizado, seguindo as recomendações do Ministério da Saúde e das campanhas nacionais de vacinação.
Tem alguma dúvida ou sugestão sobre o assunto? Comente e contribua para ampliarmos os conteúdos dos nossos artigos! Consulte também nossas Publicações Técnicas e assine a nossa newsletter para acompanhar as novidades.
Referências
- World Health Organization. Draft landscape of Covid-19 candidate vaccines. June 02, 2020. https://www.who.int/publications/m/item/draft-landscape-of-covid-19-candidate-vaccines. Acessado em 08/06/2020
- Lurie, N., Saville, M., Hatchett, R., Halton J. Developing Covid-19 Vaccines at Pandemic Speed. N Engl J Med 2020; 382:1969-1973. doi:10.1056/NEJMp2005630.
- Cheng, M. P. et al. Serodiagnostics for Severe Acute Respiratory Syndrome–Related Coronavirus-2 – A narrative review. Annal of Internal Medicine (2020). https://doi.org/10.7326/M20-2854.
- Zhu, Feng-Ci et al. Safety, tolerability, and immunogenicity of a recombinant adenovirus type-5 vectored COVID-19 vaccine: a dose-escalation, open-label, non-randomised, first-in-human trial. The Lancet (2020). https://doi.org/10.1016/S0140-6736(20)31208-3.
