Requisitos mínimos para a validação de métodos analíticos quantitativos em laboratórios clínicos
17 abr 2023
O processo de validação de métodos analíticos quantitativos possibilita uma maior segurança na rotina laboratorial, além de auxiliar na tomada de decisões, sendo recomendado a observância das Especificações da Qualidade Analítica e a análise de dados estatísticos.
Observar quais são os requisitos da qualidade adotados promove a confiabilidade dos resultados analíticos. Por isso, é fundamental que o laboratório clínico conheça e defina o nível de qualidade desejado antes de implementá-la, juntamente às práticas, no laboratório.
Também é indispensável conhecer o método utilizado para avaliar a dimensão dos possíveis erros durante o processo e decidir se são aceitáveis ou não.
Como é feita a validação de métodos analíticos
A validação consiste na ação ou processo para confirmar, por meio de ensaio e fornecimento de evidências objetivas, de que os requisitos especificados para um determinado uso são atendidos.
Inicialmente, o laboratório deve definir as especificações da Qualidade que serão utilizadas para o método, como precisão, exatidão e erro total, além de listar as características de aplicação metodológicas e de desempenho.
A atenção aos erros analíticos, deve ser o foco da validação, seguindo os seguintes questionamentos:
- Quais erros podem ocorrer em um método laboratorial?
- Quais experimentos proporcionam dados sobre esses erros?
- Qual a melhor forma de realizar os experimentos?
- Quais e quantos dados devem ser obtidos?
- Quais são as estatísticas a serem aplicadas?
- Qual a dimensão dos erros aceitáveis sem comprometer a interpretação clínica?
Quando o método é desconhecido, é sugerido realizar a avaliação preliminar: avaliação de estimativa de linearidade, replicação intra-ensaio, interferência e recuperação. Isso resultará em economia de recursos humanos e materiais nos casos em que ocorra erros significativos.
Quanto maior o número de amostras selecionadas para a avaliação da exatidão e imprecisão do método melhor a análise de dados obtidos.
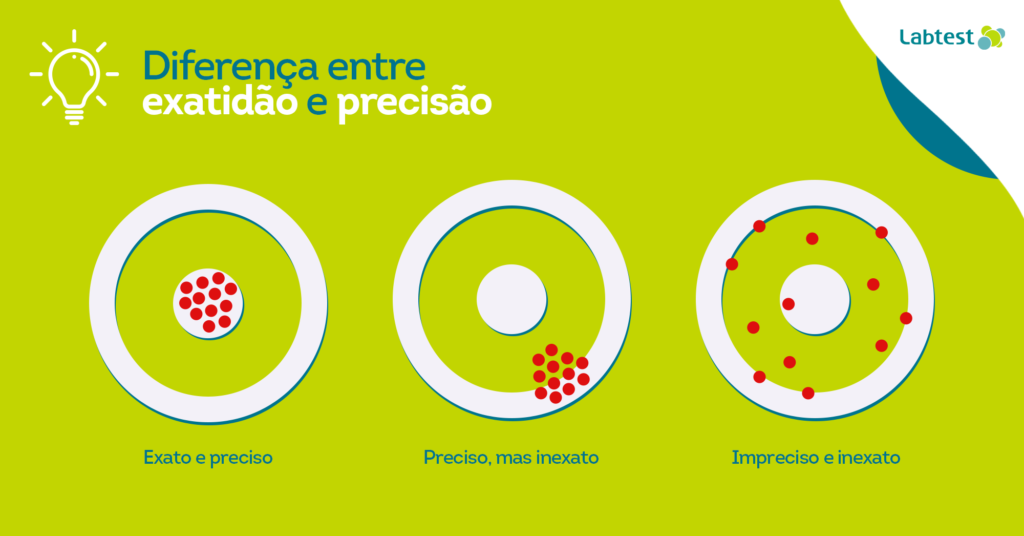
Precisão x exatidão
Apesar de serem sinônimos na língua portuguesa, quando se trata de validação de métodos, precisão e exatidão representam coisas distintas.
Segundo a CLSI EP05-02, a precisão é a concordância entre resultados independentes obtidos sob condições estipuladas. Dessa forma, a precisão se refere à capacidade de reproduzir um resultado com base em medições anteriores, apresentando mínimas variações.
Já a exatidão remete à capacidade de obter resultados mais próximos de um valor de referência, também chamado de valor verdadeiro. O ensaio de comparação interlaboratorial em um programa de ensaio de proficiência é uma das formas aferir a exatidão de um método.
A seleção das amostras para a validação de métodos devem seguir critérios de aceitabilidade: ser livres de interferentes, como hemólise, icterícia, lipemia, e etc, além de apresentar concentrações bem distribuídas, de acordo com o intervalo operacional ou linearidade do método.
Para avaliação da imprecisão, recomendamos a leitura dos documentos disponíveis no Clinical and Laboratory Standards Institute (CLSI ) que possui informações detalhadas sobre o assunto.
É recomendável que a imprecisão dos métodos estimada no Controle de Qualidade Interno atenda aos requisitos das Especificações da qualidade analítica selecionada previamente como critério de aceitabilidade. Quando a imprecisão não atende essas determinações, pode haver um impacto na correlação dos métodos e na proporcionalidade dos resultados
Comparação de métodos
A comparação de métodos é o conjunto de procedimentos que tem por objetivo estimar o erro total do método teste com o método referência. Podemos utilizar o cálculo de erro total para embasamento e dimensionamento do erro aplicado ( ERRO TOTAL = Erro Sistemático + Erro Aleatório)
Assim, é possível verificar se o método em teste é equivalente ao método comparativo e se as diferenças são aceitáveis.
É indicado avaliar os dados obtidos no Controle Interno de Qualidade certificando que este está aprovado. Respeitar os critérios de estabilidade da amostra, instruções de preparo, estabilidade de reagentes e insumos, sensibilidade e linearidade dos reagentes.
Podem ser utilizados estudos variados para avaliação se a comparação de métodos apresenta resultados conforme os requisitos estabelecidos de aceitabilidade.
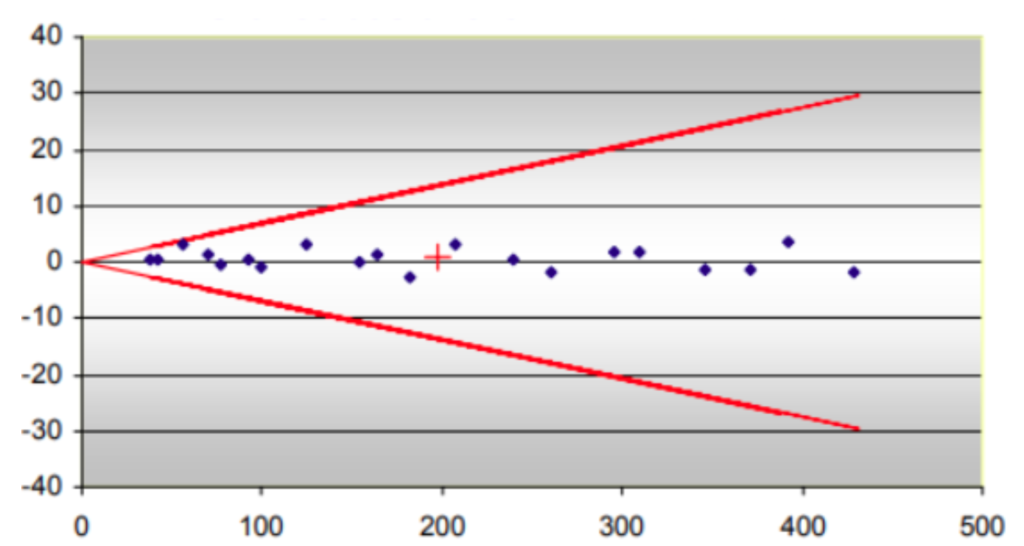
As ferramentas estatísticas de regressão linear, coeficiente de correlação (r), e gráfico de diferenças são utilizadas para avaliação inicial dos dados obtidos na comparação de métodos.
A regressão linear permite avaliar o erro sistemático constante e proporcional do método em teste. Já o coeficiente de correlação auxilia na avaliação da associação entre os resultados do método comparativo e método em teste e, por fim, o gráfico das diferenças demonstra a dispersão das diferenças entre os resultados do Sistema Teste e os resultados do Sistema Comparativo.
Estudos adicionais podem ser utilizados neste processo, como, por exemplo, estudo de linearidade, T Teste, Carryover (Estudo de carreamento), dentre outros conforme a necessidade e critérios selecionados pelo laboratório.
Implementação do método na rotina laboratorial
A próxima etapa será a implementação do método na rotina, fase final do processo de validação. Nesta fase é esperado que o processo de estimativa de erros aceitáveis, separação amostral, replicação, comparação de métodos, cálculo de erros e correlação clínica dos resultados foram realizados e o método em teste está aceitável para implantação na rotina analítica.
Nesta fase de aplicação do método na rotina é indicado:
- Estabelecer as condições de operação na rotina
- Criar procedimentos operacionais
- Definir programa de controle interno e participação em Sistema de Avaliação Externa da Qualidade
- Treinamento da equipe
- Monitoramento do Controle Interno de Qualidade e do Controle Externo de Qualidade
- Implementação de procedimentos de validação clínica
A validação de métodos quantitativos de forma satisfatória, atendendo os critérios de aceitabilidade estabelecidos por regulamentações e selecionados pelo laboratório clínico é fundamental para os resultados obtidos serem confiáveis e seguros.
Referências Bibliográficas:
Especificações da Qualidade Analítica – José Carlos Basques – Labtest Diagnóstica
Arquivo Labtest – José Carlos Basques
CLSI. Evaluation of linearity of quantitative analytical methods, EP6-A
The linearity experimente <The Linearity or Reportable Range Experiment – Westgard>
CLSI. Interference testing in clinical chemistry, EP7-A
The interference and recovery experiments <Interference and Recovery Experiments – Westgard>
The replication experimente <The Replication Experiment – Westgard>
CLSI. Evaluation of precision perfomance of clinical chemistry devices, EP5-A2
CLSI. Method comparison and bias estimation using patients samples, EP9-A2
