Resposta imunológica da COVID-19
28 maio 2020
A resposta imunológica provocada pela infecção do novo coronavírus, agente causador da COVID-19, está em fase de detalhamento pela comunidade científica. Diariamente são compartilhadas observações clínicas e laboratoriais, sendo necessário revisitar constantemente a literatura publicada sobre o assunto, a fim de esclarecer e entender os mecanismos de reação do corpo humano, após a infecção pelo SARS-CoV-2. Alguns aspectos gerais sobre o vírus já foram abordados no artigo “Coronavírus: o que você precisa saber e a situação do Brasil”.
Desde o início da pandemia, cientistas e pesquisadores do mundo inteiro trabalham para chegar em um consenso e determinar como esse agente infeccioso se comporta no organismo humano, as reações provocadas e a evolução da resposta imunológica. Detalhes como período de incubação, caracterização de sintomas, bem como o tempo e padrão de aparecimento dos anticorpos em relação à manifestação dos primeiros sintomas são determinantes para a correta conduta médica. Aspectos introdutórios relacionados à resposta imunológica foram tratados no artigo Diagnóstico in vitro: uma introdução à resposta imunológica.
Processos imunológicos decorrentes de infecções causadas por SARS-CoV-2
Reações imunológicas desencadeadas por vírus são heterogêneas e uma resposta imune inata eficiente, mediada por células e componentes solúveis, é fundamental para combater as fases iniciais de infecção causadas por vírus intracelulares, conforme explica a gerente de mercado da Labtest, Ana Luiza Maggi Marcatto. Esta resposta imediata é desencadeada por mediadores inflamatórios, como os Interferons do tipo I (IFN alpha e INF beta) e por células de defesa “sentinela”, como os macrófagos e células NK (Natural Killers).
De forma geral, na tentativa de conter uma infecção viral, os macrófagos internalizam o patógeno e provocam a “quebra” ou clivagem do vírus em pequenas porções, denominadas antígenos. Estes são, então, deslocados para a superfície do macrófago e expostos, ou seja, apresentados as outras células de defesa, como os linfócitos T CD8+ (CTL), específicos ao vírus, os quais podem controlar a viremia após 3 ou 4 dias para o vírus Influenza, segundo recente revisão publicada por Maggi e colaboradores (2020).
A apresentação dos antígenos virais aos linfócitos desencadeia também a ativação de outras células de defesa e dá início a uma resposta imunológica adaptada e mediada, inclusive, pela produção de anticorpos específicos ao vírus.
Embora a produção e cinética dos anticorpos decorrentes de infecções por SARS-CoV-2 obedeçam, em linhas gerais, ao comportamento observado em outras infecções virais como as provocadas pelos vírus Influenza (aparecimento de IgM’s específicas nos estágios iniciais da doença, seguido pela produção de IgG’s específicas nas fases mais tardias), este é um campo fértil de pesquisa e discussão.
Em sua publicação, Maggi e colaboradores (2020) citam que para os vírus Influenza, IgM’s de baixa afinidade e específicas ao vírus começam a ser produzidas entre 6 e 7 dias decorrentes da infecção, mantendo níveis elevados durante toda a fase aguda da doença. A mesma publicação cita que, após este período, anticorpos do tipo IgA e IgG, de alta afinidade, começam a ser produzidos, mas requerem tempo mais prolongado aparecendo entre 3 ou 4 semanas após a infecção. Os intervalos de tempo observados entre o início dos sintomas e o aparecimento dos anticorpos sugerem que a resposta mediada por anticorpos não implica na recuperação de pacientes após a primeira exposição aos vírus Influenza, mas podem contribuir para proteção contra nova infecção, gerando imunidade.
Para o SARS-CoV-2, o comportamento parece ser um pouco diferente. A recente revisão publicada em maio de 2020 por Azkur e colaboradores cita que, com os métodos disponíveis até o momento para a determinação de anticorpos específicos ao SARS-CoV-2, IgG’s e IgM’s atingiram o pico de concentração entre 17 e 19 dias e 20 a 22 dias decorrentes do início dos sintomas, respectivamente. Outra observação interessante é que os títulos de IgG e IgM são mais altos em casos mais graves da doença quando comparados aos casos menos graves.
“Compreender detalhadamente como as interações entre o vírus e a resposta imune acontecem nos casos da COVID-19 é crucial para desenvolver melhores estratégias terapêuticas e profiláticas. Ainda não está claro como funcionam as respostas imunes inatas e adaptadas às infecções por SARS-CoV-2”, diz Ana Luiza.
Um exemplo deste gap de informação é o fenômeno de linfopenia reportado na maior parte dos casos graves de COVID-19, sugerindo que há deficiência de ação por parte das células NK. “Estudos fenotípicos e funcionais sobre a resposta inata mediada por estas células deverão ser conduzidos em pacientes em estado grave e comparados ao perfil observado em pacientes assintomáticos, por exemplo. Pode ser que se chegue à conclusão que uma eficiente resposta imune inata seja a maior responsável por controlar a infecção ou permitir que o organismo tenha tempo para montar uma resposta imune adaptada, mais elaborada e mediada por linfócitos T, resultando em ausência de sintomas nos indivíduos ou aparecimento de sintomas leves”, completa a gerente de mercado. No caso específico da COVID-19, devido ao longo intervalo de tempo entre a infecção viral e o aparecimento de sintomas, esta resposta imune mediada por células T, crucial para o controle de infecções virais, pode não ocorrer de maneira eficaz.
Existe ainda a necessidade de esclarecimento sobre a especificidade dos anticorpos neutralizantes (NAbs) para o novo coronavírus, processo essencial para o estabelecimento da resposta imune protetora. Segundo publicado por Perlmann e colaboradores (2005), um pré-requisito para proteção contra infecções causadas por coronavírus respiratórios (rCoVs) é a ação de anticorpos específicos para o domínio de ligação (RBD), presente na proteína S dos coronavírus, como amplamente relatados em casos de SARS.
No entanto, os autores Chen e colaboradores (2020) destacam em publicação veiculada no periódico Cell Mol Immunol, um estudo conduzido com 26 pacientes recuperados da COVID-19, revelando que apenas 3 produziram anticorpos específicos para o domínio RBD. Embora estes achados coloquem em questionamento os mecanismos de imunidade previamente identificados, são importantes indícios para apoiar a escolha de antígenos candidatos a serem utilizados no desenvolvimento de vacinas.
Outras importantes informações sobre os mecanismos imunes em decorrência de infecção por SARS-CoV-2 poderão surgir a partir de estudos conduzidos em populações aparentemente menos susceptíveis às manifestações graves da doença, como a pediátrica. Em linhas gerais, crianças desenvolvem formas leves da doença ou são assintomáticas. Diferentes explicações podem ser propostas para tal fato, incluindo a grande plasticidade das respostas imunes adaptativas, particularmente mediada por linfócitos B, o constante estímulo do sistema imune causado por outras infecções constantes e pela administração de vacinas e adjuvantes na primeira infância, segundo publicado por Grimsholm e colaboradores (2020).
Entenda como funciona a soroconversão
O período que compreende a infecção do vírus e o início da manifestação dos sintomas é chamado de incubação, conforme explica Eliseu Rocha, pesquisador do Centro de Desenvolvimento, Inovação, Ciência e Tecnologia (CDICT) da Labtest. Neste intervalo de tempo, o vírus inicia a sua replicação infectando novas células e multiplicando o seu material genético para produzir mais partículas virais. De acordo com um trabalho de Lauer e colaboradores (2020), publicado no periódico Annals of Internal Medicine, a incubação do vírus pode ocorrer por um período de até 14 dias, mas estudos recentes de Jiang e colaboradores (2020) demonstram que o período médio de incubação do SARS-CoV-2 gira em torno de 5 dias.
Ao final do período de incubação, as taxas de viremia (quantidade de carga viral presente no organismo) atingem níveis elevados e o material genético do vírus passa a ser detectado por meio de técnicas moleculares de diagnóstico, como a RT-PCR.
Após este período, em decorrência das respostas imunológicas desencadeadas pela infecção, a carga viral diminui, ao mesmo tempo que imunoglobulinas (anticorpos) são produzidas e passam a ser detectáveis, ou seja, tem início o processo de soroconversão. “Quando o organismo do indivíduo começa a aumentar os níveis de anticorpos produzidos e os mesmos atingem níveis passíveis de serem detectados, nós chamamos de soroconversão. Os anticorpos que, normalmente, aparecem neste momento são os anticorpos IgM, seguidos dos anticorpos IgA e IgG”, reforçou o pesquisador, informando que cada indivíduo constrói a sua resposta imunológica de forma única.
As diferenças de comportamento de respostas imunológicas observadas de indivíduo para indivíduo fazem com que haja grande discussão em relação à determinação do tempo correto em que a soroconversão ocorre nos casos de COVID-19.
O que se sabe até agora sobre a soroconversão em casos de COVID-19
Apesar de estudos realizados com outros vírus da família Coronaviridae apontarem que surgem primeiro as IgM´s, seguida pelas IgG´s, foi observada a ocorrência de soroconversão concomitante ou invertida nos casos de infecção por SARS-CoV-2, como relatado no estudo publicado na Nature Medicine por Long e colaboradores (2020). No estudo citado, inicialmente conduzido com 285 pacientes e posteriormente reduzido para 63, a soroconversão observada no modelo estudado aponta inicialmente o aparecimento de IgG e, logo após, do IgM. Nesta mesma publicação, “o início da soroconversão foi observado, em média, após 13 dias decorridos da infecção”, salientou o pesquisador.
Além dos anticorpos IgM e IgG, outra classe de anticorpos está ganhando destaque na comunidade científica no curso da resposta imunológica da COVID-19: a classe de IgA, conforme mencionado pela especialista de produtos da Labtest, Bárbara Patrícia de Morais. Em um estudo publicado na Clinica Chimica Acta por Padoan e colaboradores (2020), foi avaliada a cinética dos anticorpos IgA, IgM e IgG por 6 semanas (42 dias) em pacientes sintomáticos para COVID-19, cujo diagnóstico foi confirmado por RT-PCR. Os testes foram realizados, empregando-se produtos com as metodologias de quimioluminescência para IgM e IgG e ELISA para IgA e IgG disponíveis no mercado.
A cinética do IgA foi avaliada em 19 pacientes e apresentou tempo médio de aparecimento de 7,5 dias. Já para IgM, a cinética foi acompanhada em 51 pacientes e o tempo médio de aparecimento foi de 4,6 dias. De acordo com os autores, os níveis de IgA e IgM aumentam entre o 6º e 8º dia, após o surgimento dos sintomas.
Os autores também reforçaram que os níveis de IgA permaneceram elevados durante o período de estudo, com pico entre o 20º e o 22º dia. Já os níveis de IgM tiveram pico entre o 10º e 12º dia, com diminuição significativa dos níveis após o 18º dia. “Apesar de ser observada heterogeneidade entre alguns pacientes em relação aos dias e pico dos anticorpos, a persistência do IgA ao longo do curso da resposta imunológica foi unânime”, completa Bárbara. Cabe ainda ressaltar que os níveis de IgA foram detectáveis, já na primeira semana de sintomas, em 75% dos pacientes, de acordo com este estudo.
Testes diagnósticos e suas aplicações nas diferentes fases da COVID-19
Deve-se considerar a fase da doença na qual o paciente se encontra, a fim de escolher o método diagnóstico a ser utilizado, conforme ilustrado pela figura 1.
Atualmente, são utilizados dois tipos de metodologia de auxílio ao diagnóstico para os casos de COVID-19. “É muito importante salientar que, independentemente do método diagnóstico escolhido, os resultados devem ser sempre interpretados à luz dos sintomas e achados clínicos identificados durante o atendimento médico. Testes negativos em pacientes sintomáticos, ou de indivíduos que entraram em contato com pacientes sabidamente positivos, deverão ser analisados com cautela”, diz Ana Luiza.
- Metodologia molecular: técnica de RT-PCR em tempo real que utiliza, como amostra, secreções de lavado broncoalveolar, escarro, swab nasal ou orofaringe (garganta). Considerada metodologia padrão-ouro para o diagnóstico das infecções causadas pelo SARS-CoV-2, baseia-se na identificação do material genético do vírus e, por este motivo, é a metodologia de escolha nos estágios iniciais da doença. “É possível fazer um teste de RT-PCR em tempo real para detecção de partes do genoma viral com certa segurança e ter um diagnóstico adequado, desde que a amostra tenha sido corretamente coletada”, explica Rocha.
- Metodologias sorológicas: baseiam-se em imunoensaios, objetivando a identificação de antígenos ou anticorpos específicos para o vírus. Os produtos comerciais mais utilizados são os testes baseados nas metodologias de ELISA, Quimioluminescência e Imunocromatografia.
No modelo que preconiza a identificação de antígenos, são utilizados os mesmos tipos de amostras indicados na técnica molecular. Já nas técnicas que detectam anticorpos, identificam-se anticorpos IgA, IgM e/ou IgG, em conjunto ou separadamente, podendo ser detectado mais de um anticorpo em um mesmo produto. São técnicas indicadas para serem utilizadas a partir de 10 dias decorrentes do início dos sintomas. No entanto, este período ainda não é preciso nos casos de infecção por SARS-CoV-2, pois, além das variações decorrentes da construção da resposta imunológica de cada indivíduo, os níveis de anticorpos são aparentemente influenciados pela carga viral existente.
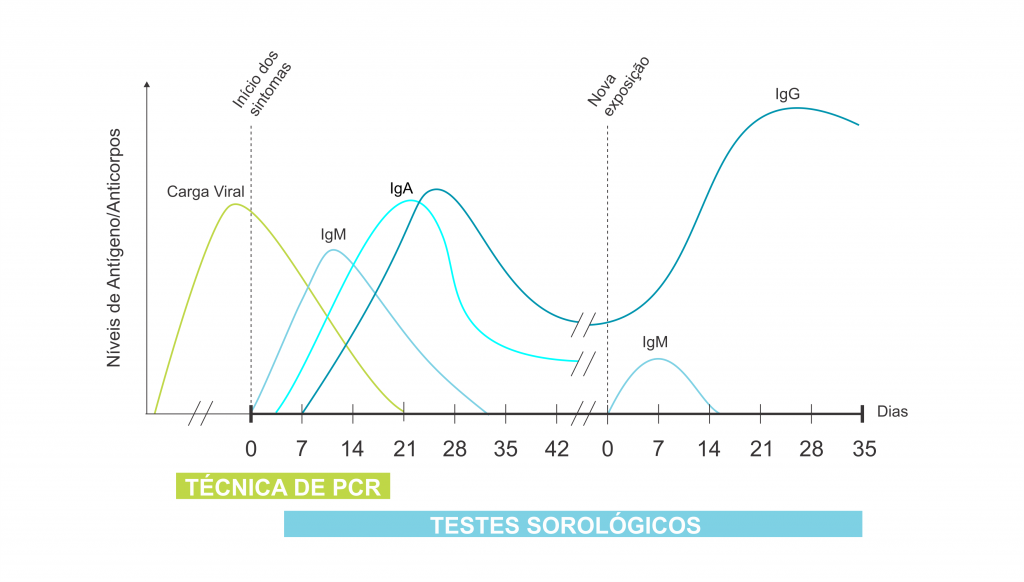
Figura 1. Resposta imunológica após a infecção pelo novo coronavírus (SARS-CoV-2) e sua relação com os testes de diagnóstico.
Conceito de imunidade e a reinfecção
O conceito de imunidade, adotado para alguns vírus da família Coronaviridae, ainda não está totalmente elucidado para as infecções por SARS-CoV-2. O tempo de permanência dos anticorpos após a infecção pelo vírus, a capacidade neutralizante destes e a manutenção da memória celular em uma possível reinfecção, com produção mais rápida dos anticorpos, ainda não foram esclarecidos para a COVID-19. Não é possível afirmar que um indivíduo que tenha sido infectado pelo SARS-CoV-2 está imune e não desenvolverá novamente a doença em uma possível reinfecção.
“É muito cedo falar sobre reinfecção. Nós precisamos construir esse conhecimento ainda. Acredito que teremos alguma resposta pós-pandemia. Considerando casos de infecções virais clássicos, a reinfecção para os vírus da família coronavírus não ocorre para aquele mesmo vírus. Por exemplo, não há relatos de que quem teve SARS em 2002, tenha tido SARS novamente. Da mesma forma, para quem contraiu MERS, não existem relatos de uma segunda ocorrência. Agora, nós não sabemos afirmar, a respeito do novo coronavírus, sobre qual vai ser o seu comportamento detalhado em termos de epidemiologia. Precisamos de estudos conduzidos por mais tempo. O SARS-CoV é diferente do SARS-CoV-2”, finalizou Rocha.
Tem alguma dúvida ou sugestão sobre o assunto? Comente e contribua para ampliarmos os conteúdos dos nossos posts! Consulte também nossas publicações e assine a nossa newsletter para acompanhar as novidades
Referências
Jiang X., Rayner S., Luo M‐H. “Does SARS‐CoV‐2 has a longer incubation period than SARS and MERS?” J Med Virol. 2020;92:476–478.
Long, Q., Liu, B., Deng, H. et al. “Antibody responses to SARS-CoV-2 in patients with COVID-19”. Nat Med (2020).
Padoan A., Sciacovelli L., Basso D., Negrini D., Zuin S., Cosma C., Faggian D., Matricardi P.,Plebani M., “IgA-Ab response to spike glycoprotein of SARS-CoV-2 in patients with COVID-19: A longitudinal study”, Clinica Chimica Acta, Volume 507 (2020).
Maggi E., Canonica G.W., Moretta L. “COVID-19: unanswered questions on immune response and pathogenesis”, Journal of Allergy and Clinical Immunology (2020).
Perlman S., Dandekar A. A. “Immunopathogenesis of coronavirus infections: implications for SARS”. Rev Immunol (2005).
Chen X., Li R., Pan Z., Qian C., Yang Y., You R., et al. “Human monoclonal antibodies block the binding of SARS-CoV-2 spike protein to angiotensin converting enzyme 2 receptor”. Cell Mol Immunol (2020).
Grimsholm O., Piano Mortari E., Davydov A.N., Shugay M., Obraztsova A.S., Bocci C., et al. “The Interplay between CD27 and CD27 B Cells Ensures the Flexibility, Stability, and Resilience of Human B Cell”. Memory. Cell Rep (2020).
Azkur A. K., Mübeccel Akdis Dilek Azkur Milena Sokolowska Willem van de Veen Marie‐Charlotte Brüggen Liam O’Mahony Yadong Gao Kari Nadeau Cezmi A. Akdis.”Immune response to SARS‐CoV‐2 and mechanisms of immunopathological changes in COVID‐19”. Allergy (2020).
Lauer S., Grantz K., Bi Q., Jones F., et al. The Incubation Period of Coronavirus Disease 2019 (COVID-19) From Publicly Reported Confirmed Cases: Estimation and Application. Ann. Intern. Med. 2020;172(9):577-582. doi: 10.7326/M20-0504.
